LABORATORIO DE PROTEÍNAS FUNCIONALES EN FUSIÓN DE MEMBRANAS, CÁNCER Y EVOLUCIÓN
Responsable: Dra. Claudia Tomes
Nuestro laboratorio estudia los mecanismos de fusión de membranas que gobiernan la exocitosis regulada del único gránulo denso contenido en el espermatozoide. Esta exocitosis se denomina reacción acrosomal (RA), es imprescindible para la fertilidad y está mediada por por lípidos, segundos mensajeros y proteínas evolutivamente muy conservadas. El hecho de que las proteínas (y aparentemente también los mecanismos) que gobiernan la exocitosis sean universales hace que los científicos podamos concentrar nuestros esfuerzos en unos pocos modelos secretorios adecuados y extrapolar los hallazgos a otros sistemas de más difícil escrutinio. El espermatozoide es muy favorable para estudios funcionales, morfológicos y bioquímicos, lo cual nos confiere visibilidad internacional y acceso a audiencias amplias y diversas. Nuestros proyectos tienden puentes entre dos campos inconexos: los biólogos reproductivos no estudiaban mecanismos de fusión de membranas y los que trabajaban en exocitosis no incluían al espermatozoide como modelo.
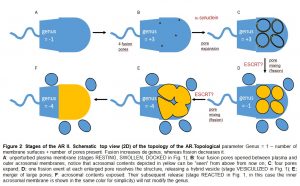
Nuestros conocimientos sobre los cambios morfológicos que ocurren en la cabeza de los espermatozoides durante la RA son suministrados por las imágenes capturadas por microscopías de luz y electrónica de transmisión (Figura 1). Los modelos bidimensionales no son los más adecuados para reflejar las reorganizaciones de la membrana que deben ocurrir durante la vesiculización y la expansión de los poros. Para ello, es necesario incorporar una tercera dimensión espacial a los modelos y aplicar principios topológicos (Figura 2). Para nuestra sorpresa, los cambios en el “parámetro topológico genus” revelaron que la exocitosis del acrosoma implica tanto la fusión como la fisión de las membranas. Actualmente nos enfocamos en elucidar cómo se expanden los poros de fusión para liberar el contenido del gránulo. Descubrimos que la expansión no es catastrófica como se creía sino finamente regulada y que requiere alfa sinucleína (Figura 3A) y la hidrólisis de GTP en Rab3. Algo inesperado fue que en las etapas finales de la RA, después de la apertura y expansión de poros de fusión, sucede la FISIÓN de membranas por lo que estamos caracterizando el requerimiento de IST1, miembro del complejo de ESCRTIII (Figura 3B).
Para identificar moléculas clave y desentrañar vías de transducción de señales y la interrelación entre ellas, desarrollamos/aplicamos nuevas técnicas y herramientas. Estas incluyen la producción de proteínas fusionadas a péptidos permeables que les permiten transducirse al interior de células eucariotas, como por ejemplo la PTP1B (Figura 4B) y a-sinucleína (Figura 1), la aplicación de sondas fluorescentes y microscopías sofisticadas.

Líneas de investigación
Línea de investigación 1: Apertura y expansión de poros de fusión durante la RA de espermatozoides humanos: papel de a-sinucleína
Esta línea constituye el trabajo de tesis doctoral de la Lic. Micaela Vanina Buzzatto.
La RA involucra grandes cambios en la topología de la cabeza del espermatozoide humano: el acrosoma se hincha, la membrana acrosomal externa se curva hasta contactar la membrana plasmática, poros de fusión se abren en las zonas de contacto y se expanden hasta que eventualmente las dos membranas se vesiculizan y eliminan (Figura 1). Rab3 se activa (intercambia GDP por GTP) en una etapa temprana de la exocitosis espermática y posteriormente se inactiva (hidroliza el GTP unido) durante una etapa tardía. Si a Rab3 se le impide hidrolizar GTP, la exocitosis se detiene después de la fusión de las membranas pero antes de la expansión de los poros y vesiculización.
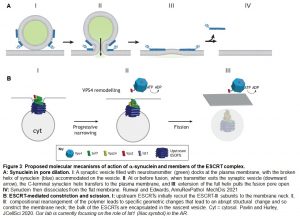
La α-sinucleína es una proteína pequeña involucrada en múltiples eventos de tráfico. De particular relevancia para mi laboratorio fue el hallazgo de que α-sinucleína regula la estabilidad del poro de fusión en neuronas y células cromafines. α-sinucleína interactúa con componentes fundamentales de la maquinaria de fusión tales como Rab3 y miembros de la familia SNARE. Al interactuar con Rab3A-GTP, la α-sinucleína se recluta a membranas y modifica su curvatura. Luego de demostrar la presencia de α-sinucleína en espermatozoides humanos y su requerimiento en la RA a posteriori de la apertura de poros de fusión (Buzzatto et al, 2023), la Lic. Buzzatto está estudiando la influencia de a-sinucleína en la cinética de la apertura y expansión de poros en respuesta a progesterona por videomicroscopía en tiempo real.
Colaboramos con los equipos de los Dres. Diego Masone y Luis Mayorga, quienes realizan abordajes computacionales, con la Dra. Victoria Berberián, que realiza estudios que involucran microscopía electrónica y con el Dr. Jorge Ibáñez, responsable de los desarrollos matemáticos necesarios para interpretar los resultados obtenidos por videomicroscopía.
Línea de investigación 2: La fisión post-fusión es el evento más tardío de la RA y es catalizado por proteínas de los complejos ESCRT (Endosomal Sorting Complex Required for Transport)
Esta línea constituye el trabajo de tesis doctoral de la Lic. Cora Gisel Sandoval.
Existen dos mecanismos principales para la fisión de membranas: uno es cuando la escisión consiste en cortar un canal de membrana rodeado de citosol (generalmente impulsado por dinamina) y otro que se lleva a cabo en los eventos de gemación (mediado por el complejo de proteínas ESCRT). En esta línea nos proponemos detectar los cambios morfológicos que ocurren en la cabeza de los espermatozoides humanos durante los eventos post-fusión de la RA e identificar los miembros de la maquinaria proteica que regula cada una de estas etapas, nuestras primeras candidatas son las ESCRT III, quienes escindirían los puentes citoplasmáticos necesarios para liberar las vesículas (Figura 2C-D) y también podrían estar involucradas en la segunda ronda de eventos de fisión que conducen a la mezcla de los grandes agujeros dejados por las vesículas híbridas (Figura 2D-E). La Lic. Sandoval ha encontrado evidencias de la presencia de la proteína IST1, miembro del complejo ESCRT III, en el espermatozoide humano y de su requerimiento para la RA.
Línea de investigación 3: Diseño, expresión y purificación de proteínas permeables y su transducción en células eucariotas.
Esta línea constituye el trabajo actual del Dr. Marcelo Roggero al incorporarse a mi laboratorio y antes de iniciar su línea propia en cáncer de próstata. El Dr. Roggero supervisa a la estudiante de la Licenciatura en Biología (FCEN, UNCUYO) Jazmín Dichara.
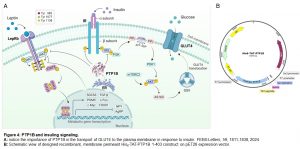
Hemos diseñado un vector plásmido para expresar en Escherichia coli proteínas de interés fusionadas a un His6 tag y al péptido TAT del virus del HIV. Hemos publicado la transducción e influencia en la RA de Rab27A, una esponja de AMP cíclico y la subunidad catalítica de la toxina botulínica B a espermatozoides humanos. En la descripción de la línea 1 mencionamos la influencia de His6-TAT-a-sinucleína en la cinética de la RA. Sabemos que PTP1B juega un papel crucial en la RA (Figura 1), pero no sabemos cómo se regula su actividad durante la exocitosis del espermatozoide humano. Actualmente estamos trabajando con una versión permeable de PTP1B (Figura 4) para elucidar dicha regulación así como el papel de la fosfatasa en la defosforilación de proteínas en tirosina y el transporte de GLUT4 en mioblastos en cultivo.
Colaboramos con los equipo del Dr. Martín Pavarotti, quien realiza el cultivo y parte de los análisis en células musculares y con la Dra. María Laura Mascotti, quien mide los parámetros cinéticos de la actividad enzimática de la PTP1B recombinante.