- Acosta, Cristian Gabriel
- Belmonte, Silvia Alejandra
- Berón, Walter
- Bustos, Diego Martín
- Castro Vázquez, Alfredo
- Cebrián, Ignacio
- Colombo, María Isabel
- Croci Russo, Diego
- Delgui, Laura Ruth
- Fader Kaiser, Claudio
- Fornés, Miguel Walter
- Masone, Diego
- Mayorga, Luis
- Michaut, Marcela Alejandra
- Muñoz, Estela Maris
- Penissi, Alicia Beatriz
- Romano, Patricia Silvia
- Roqué Moreno, María
- Ruete, María Celeste
- Sosa Escudero, Miguel A.
- Tomes, Claudia Nora
- Vega, Israel
LABORATORIO DE INVESTIGACIONES ANDROLÓGICAS DE MENDOZA (LIAM)
El laboratorio busca definir los mecanismos del desarrollo de los espermatozoides y sus funciones en modelos animales usados en medicina traslacional y en especies en su ambiente natural.
Líneas de investigación:
Colesterol y desarrollo del espermatozoide
El colesterol es una molécula clave en la biología del espermatozoide. Participa en su formación en el testículo así como una vez incorporado a la gameta en sus funciones antes y durante la fecundación.
Maduración en el epidídimo del espermatozoide
Proteínas presentes en el lumen epididimario actúan como posibles factores que protegen al espermatozoide de efectos nocivos de la oxidación y posteriormente favorecen los procesos de fecundación.
Desarrollo del espermatozoide en especies adaptadas a zonas semi-aridas
El ambiente influye profundamente en las especies que allí se desarrollan determinando mecanismos de adaptación en los sistemas reproductivos. El desarrollo de espermatozoides en esas especies exige condiciones particulares.
Líneas de trabajo:
I. Efecto de la hipercolesterolemia (HC) en la fertilidad masculina. Reversión de los efectos negativos de la HC por aceite de oliva virgen extra
El consumo excesivo de grasa conlleva a trastornos generales (ej: arterioesclerosis) pero también a alteraciones de los parámetros indicativos de fertilidad masculina. Interesantemente, estas alteraciones espermáticas y seminales, se revierten con la ingesta de aceite de oliva virgen extra (AOVE). Estos estudios se desarrollan en modelos específicos de Medicina Traslacional (conejo New Zealand).
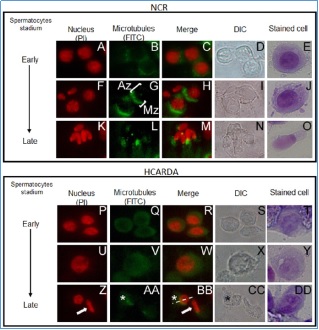
Organización del manchette durante la espermiogénesis. En el recuadro superior (NCR = conejo normocolesterolemico) se ven células aisladas del túbulo seminífero, particularmente espermatocitos. Se observa claramente la posición del complejo de microtúbulos denominado manchette (anti–tubulina, verde) localizado en la zona post ecuatorial del futuro espermatozoide (cuyo núcleo se ha teñido en rojo, ioduro de propidio). En tanto que en el panel inferior, las células corresponden a conejos hipercolesterolémicos (HCARDA). Nótese que la distribución (tinción en verde) deja de estar en un polo del núcleo para distribuirse homogéneamente. Esta disposición anómala de microtúbulos lleva a espermatozoides malformados. 650X.
II. Regulación de la motilidad espermática
En otra línea de trabajo estudiamos el flagelo del espermatozoide, como las proteínas que lo conforman, los efectos sobre la motilidad que tienen los eventos oxidativos, y su reversión en condiciones fisiológicas.
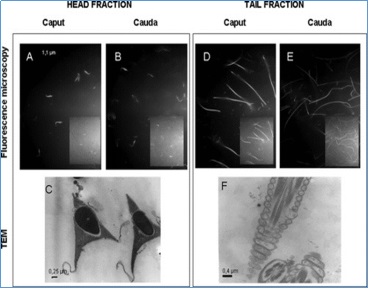
Fraccionamiento y aislamiento de la cabeza y cola del espermatozoide aislado de caput y cauda de epidídimo. Fracciones de células de esperma después de sonicación y centrifugación en dos pasos de gradiente de sacarosa. Microscopía de fluorescencia de mBBr fracción de cabeza de esperma marcada de caput (A), cauda (B), fracción de cola de esperma de caput (D) y cauda (E), 630 ×. El recuadro muestra la imagen de contraste de fase correspondiente (A, B, D y E). La pureza de las fracciones de cabeza (C) y colas (F) se verificó mediante microscopía electrónica de transmisión. C: × 30,000, F: × 20,000. N: núcleo, P: perforatorio, PP: pieza principal, MP: pieza intermedia.
III. Maduración epididimaria de los espermatozoides
Los espermatozoides deben transitar por el epidídimo para madurar. Diferentes fenómenos tienen lugar, y entre ellos la asociación de espermatozoides. Nuestros trabajos han permitido aislar y caracterizar factores involucrados en dicho proceso.
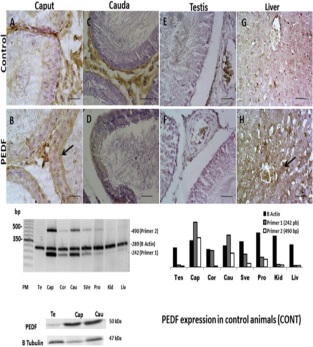
Expresión de PEDF en el tracto reproductor masculino de animales de control. Panel superior, inmunotinción: las secciones de caput del epidídimo (B) muestran la tinción sobre el borde apical de las células principales (flecha) y sobre todo el citoplasma en las secciones de cauda (D). Tenga en cuenta que se detectó una reacción no positiva en las muestras de testículo (F). La figura (H) muestra una sección del hígado con tinción positiva para PEDF sobre el citoplasma de hepatocitos (flecha). Secciones similares correspondientes controles negativos se muestran en la fila de control (A, C, E y G). Barra de escala = 80 μm. Panel medio: PCR triplicada semicuantitativa (representativa de tres experimentos independientes) para el ARNm de la PEDF y la actina B. El gel es 2% agarosa. Se utilizaron dos cebadores 1 (242 pb) y 2 (490 pb). El ARNm de PEDF se expresó en Caput (Cap); Corpus (Cor); Cauda (Cau); Vesículas seminales (SVe) y próstata (Pro). Se observó una leve marca en la muestra de hígado y riñón (Liv and Kid). No había expresión en los testículos (Te). Se representó una cuantificación relativa de la intensidad de la banda para el ARNm de actina PEDF y B como unidades arbitrarias (derecha). Panel inferior: Western blot. Testículos, caput y muestras de cauda. Se utilizó tubulina B como control de carga.
IV. Efectos del medio ambiente en la gónada masculina
El ambiente próximo y lejano ejerce un efecto en el desarrollo de la gónada masculina. Las variaciones anuales del clima, disponibilidad de luz natural y otros factores – a través de la pineal – influyen en el desarrollo testicular y/o su involución siguiendo las estaciones. Nuestros trabajos analizan la influencia de las variables medio-ambiente en las gónadas masculinas en especies nativas.
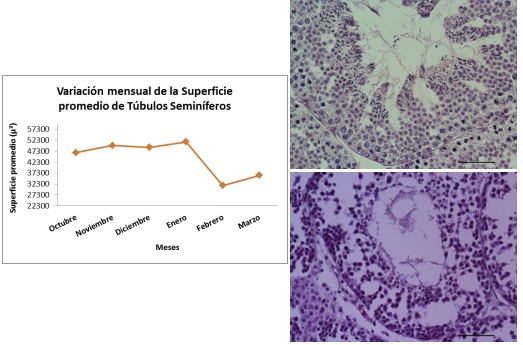
Los túbulos seminíferos de los meses cálidos, con mayor cantidad de horas de luz diurna (A, diciembre) contrasta con la disminución del trofismo de los mismos en el mes de Marzo (B).
