- Acosta, Cristian Gabriel
- Belmonte, Silvia Alejandra
- Berón, Walter
- Bustos, Diego Martín
- Castro Vázquez, Alfredo
- Cebrián, Ignacio
- Colombo, María Isabel
- Croci Russo, Diego
- Delgui, Laura Ruth
- Fader Kaiser, Claudio
- Fornés, Miguel Walter
- Masone, Diego
- Mayorga, Luis
- Michaut, Marcela Alejandra
- Muñoz, Estela Maris
- Penissi, Alicia Beatriz
- Romano, Patricia Silvia
- Roqué Moreno, María
- Ruete, María Celeste
- Sosa Escudero, Miguel A.
- Tomes, Claudia Nora
- Vega, Israel

LABORATORIO DE ESTUDIOS NEUROBIOLOGICOS (LABENE)
Nuestro laboratorio está enfocado en el estudio de las bases moleculares y celulares que subyacen a las alteraciones fisiológicas que afectan diferentes aspectos del funcionamiento normal del sistema nervioso. Específicamente, nos interesa comprender las bases neurobiológicas del dolor crónico patológico, con especial énfasis en los cambios que ocurren a lo largo del envejecimiento y en modelos de dolor inflamatorio y neuropático. Nuestras líneas de investigación se centran en el estudio de canales iónicos de potasio y marcadores de neuronas nociceptivas, así como en receptores canónicos de angiotensina II y en sistemas de regulación de la neuritogénesis. El objetivo general del LABENE es identificar blancos terapéuticos innovadores para el tratamiento del dolor patológico refractario; validar el potencial de dichos tratamientos y avanzar el conocimiento general sobre las causas moleculares y celulares del dolor crónico.
Rol de los canales de potasio de 2 poros (K2P) en la génesis y mantenimiento del dolor crónico
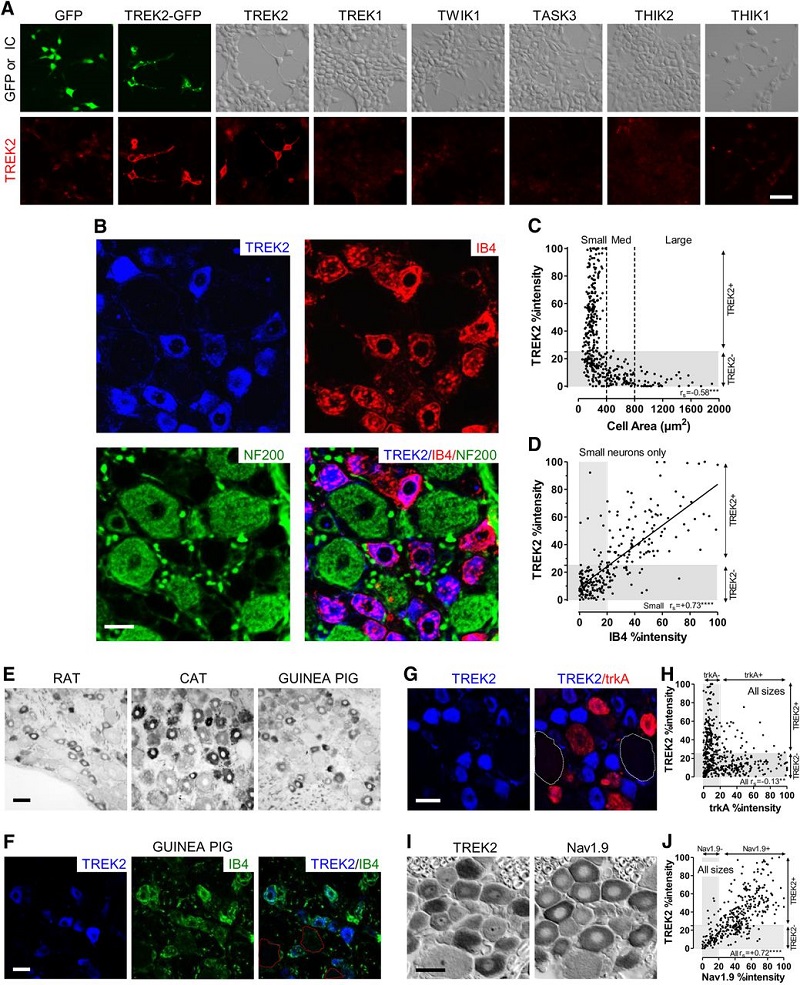
Nuestro laboratorio estudia el papel de los canales de potasio de fuga de dominio de 2 poros (K2P) en la génesis y mantenimiento del dolor crónico patológico de tipo inflamatorio y neuropático. Desde 2012, esta línea de investigación ha permitido establecer de qué manera cambia la expresión de estos canales en neuronas sensoriales aferentes primarias del ganglio de la raíz dorsal (GRD) en ratas (Marsh et al., 2012) (Figura 1) y el papel clave que cumple el canal TREK2 en hiperpolarizar neuronas IB4-positivas, limitando la ocurrencia de dolor espontáneo (Acosta et al., 2014) (Figura 2).
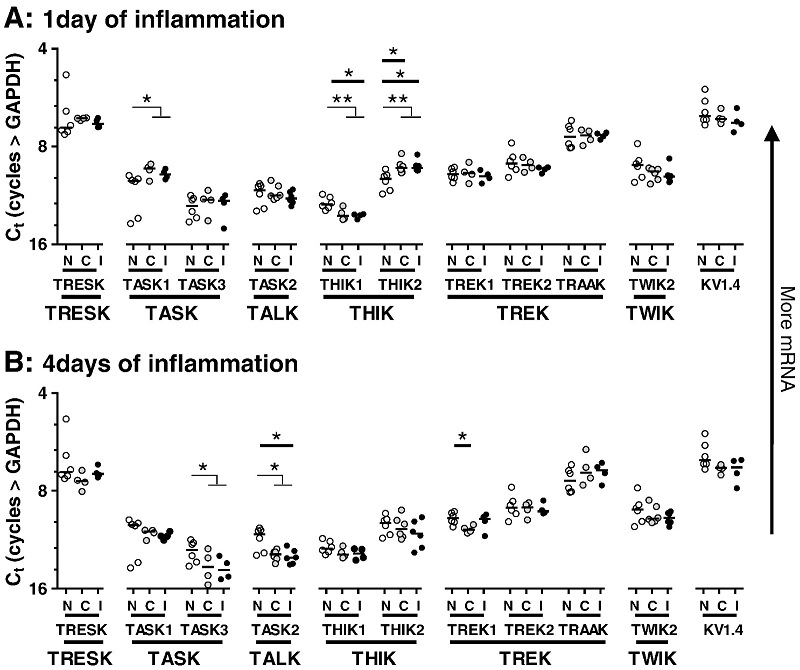 Figura 1
Figura 1
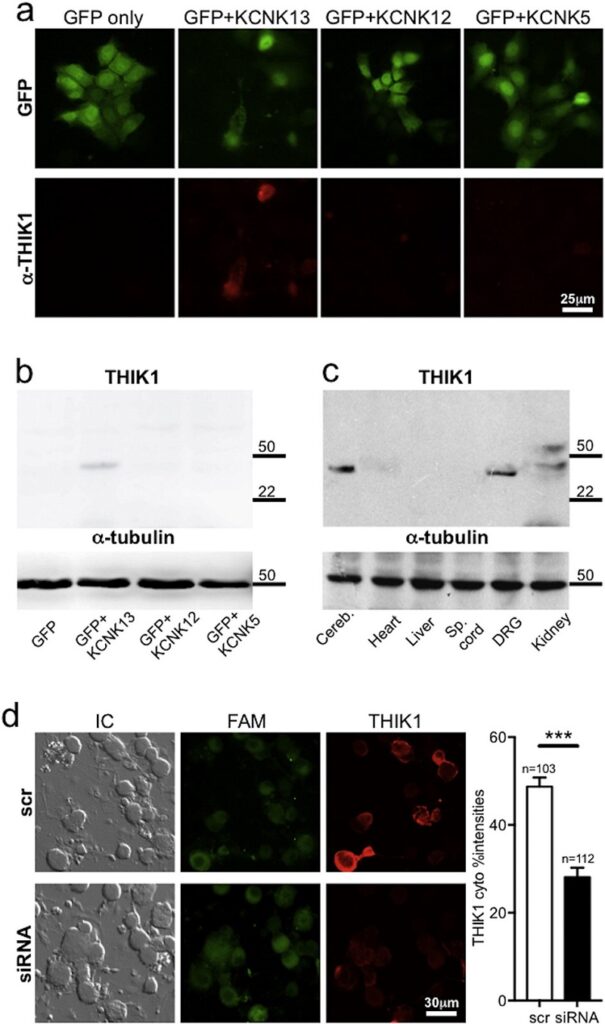
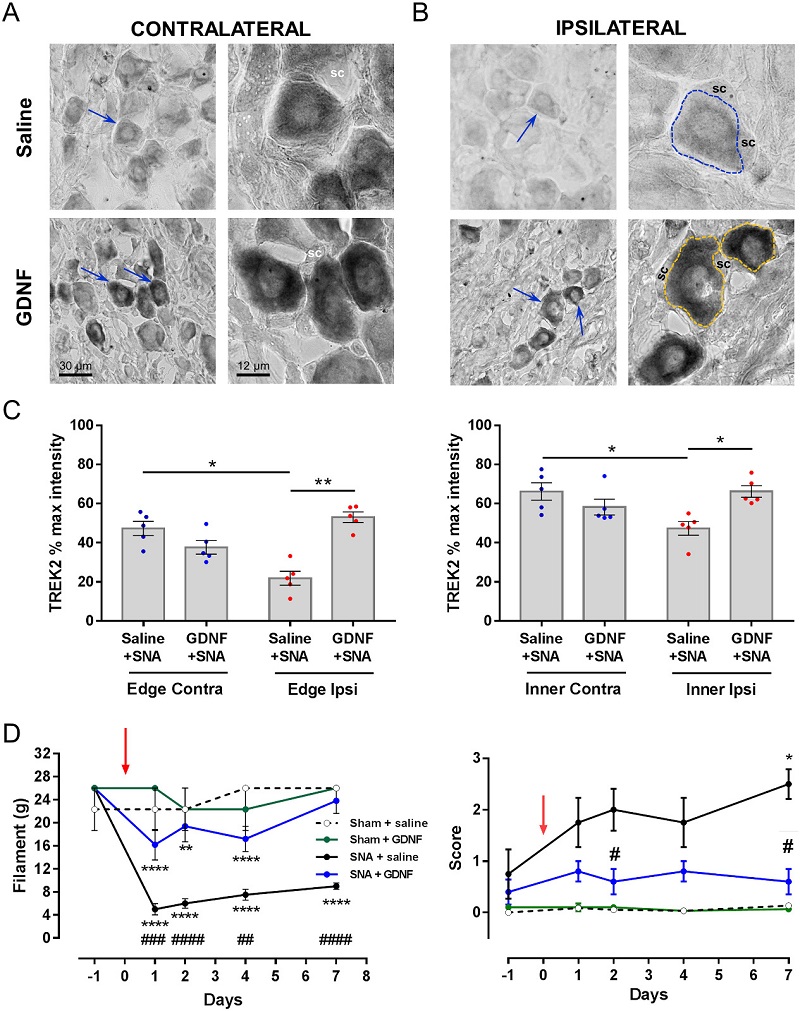
Luego establecimos que el canal THIK1, expresado en neuronas nociceptivas peptidérgicas y no peptidérigas del GRD, también contribuye al dolor espontáneo asociado a inflamación cutánea aguda (Haskins et al., 2017) (Figura 3). Recientemente, demostramos que el factor de crecimiento derivado de glia (GDNF) es capaz de restablecer la expresión normal del canal TREK2 en un modelo de dolor neuropático por axotomía del L5, aliviando significativamente la alodinia mecánica asociada a la lesión con escasos efectos sobre la alodinia fría en ratas tratadas por 7 días con el factor (Messina et al., 2022) (Figura 4).
Con estos antecedentes, estamos embarcados en esclarecer el rol de otros canales K2P en modelos de dolor crónico, y su posible regulación por otros factores tróficos. En forma paralela, estamos evaluando si diferentes compuestos (primariamente terpenoides) logran modular positivamente los canales K2P expresados en las neuronas del GRD, para evaluar su potencial terapéutico.
Rol de los receptores de Angiotensina II en dolor crónico inflamatorio y neuropático
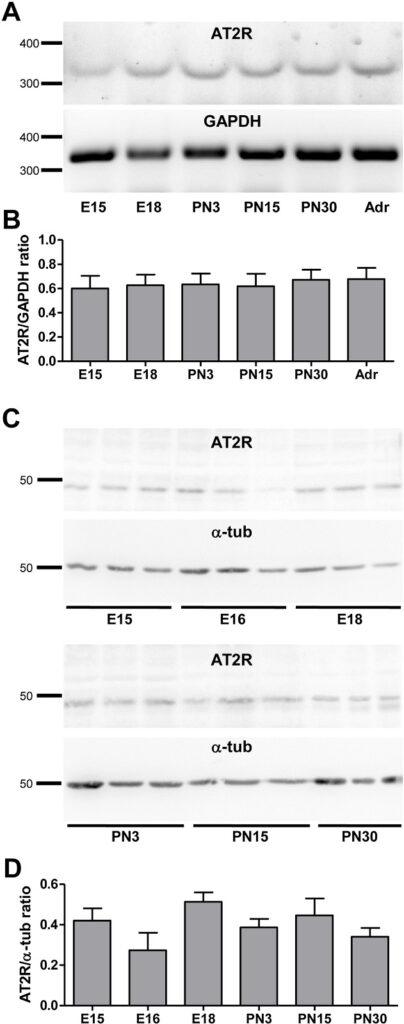
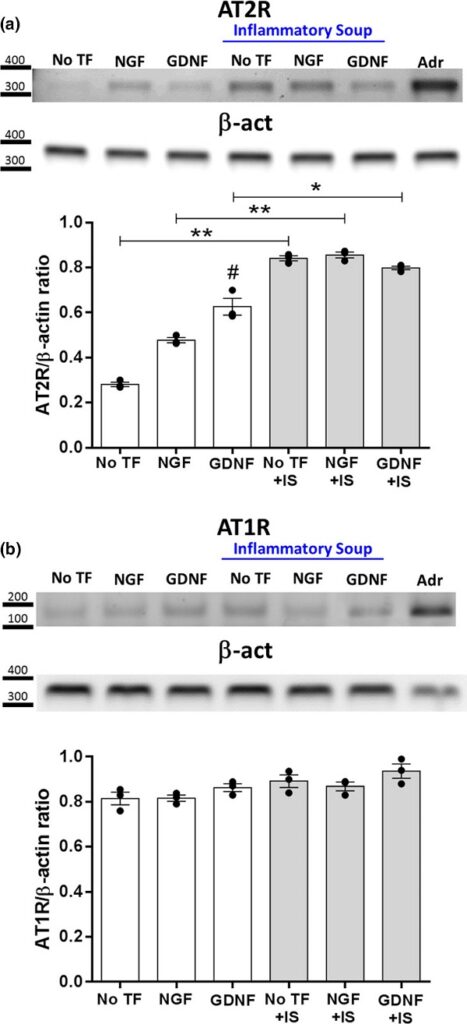
En nuestro laboratorio demostramos por primera vez que el receptor de tipo 2 para Angiotensina II (AT2R) se expresa desde los estadios embrionarios en diferentes subpoblaciones de neuronas del GRD (Benitez et al., 2017) (Figura 5). Basados en evidencia de la literatura que proponía un rol protector para AT2R y un potencial rol pro-algésico e inflamatorio para AT1R, estudiamos en detalle tanto la expresión como la actividad fisiológica de ambos receptores en un modelo de inflamación cutánea. Descubrimos que la estimulación por Ang-II de AT1R y AT2R promueve neuritogénesis preferencialmente en neuronas peptidérgicas y no peptidérgicas respectivamente. También demostramos que AT2R está bajo control de GDNF (pero no NGF) y de una sopa pro-inflamatoria en tanto que la expresión de AT1R parece ser independiente de ambos factores tróficos (Benitez et al., 2020) (Figura 6).
Uno de los proyectos actuales busca establecer si el sistema RAS, y especialmente Ang-II es capaz de controlar la actividad nociceptiva vía el control positivo de la expresión y/o función de canales K2P específicos. Otro proyecto busca establecer si hay un control mutuo y cruzado (crosstalk) entre los receptores de Ang-II y las citoquinas pro-inflamatorias que in vitro tienen efecto sobre los niveles de ARNm para ambos receptores. Finalmente, estamos interesados en establecer el rol de AT1 y AT2 en una sub-poblaciones de neuronas del núcleo ventral lateral de la formación gris periacueductal, en ratas jóvenes y envejecidas expuestas a inflamación aguda y crónica.
Modulación diferencial de marcadores nociceptivos canónicos durante el envejecimiento normal y patológico
El dolor crónico patológico es de mayor incidencia y peor respuesta terapéutica en individuos mayores de 65 años. Este grupo etario envejecido es refractario a la mayoría de los tratamientos disponibles, o sucumben a los efectos secundarios de medicamentos anti-inflamatorios que poseen elevada toxicidad gástrica, renal y cardiovascular. Estos datos epidemiológicos y el creciente envejecimiento de la población demandan investigaciones más profundas sobre qué sucede con los nociceptores a medida que los organismos transicionan desde la pubertad a la vejez. En un estudio clave, con gran impacto, publicado en 2023, demostramos que en efecto la expresión y actividad de 4 marcadores nociceptivos canónicos (Nav1.8, P2X3, ASIC3 y TRPM8) sufren notables cambios durante el envejecimiento normal (Messina et al., 2023) (Figura 7).
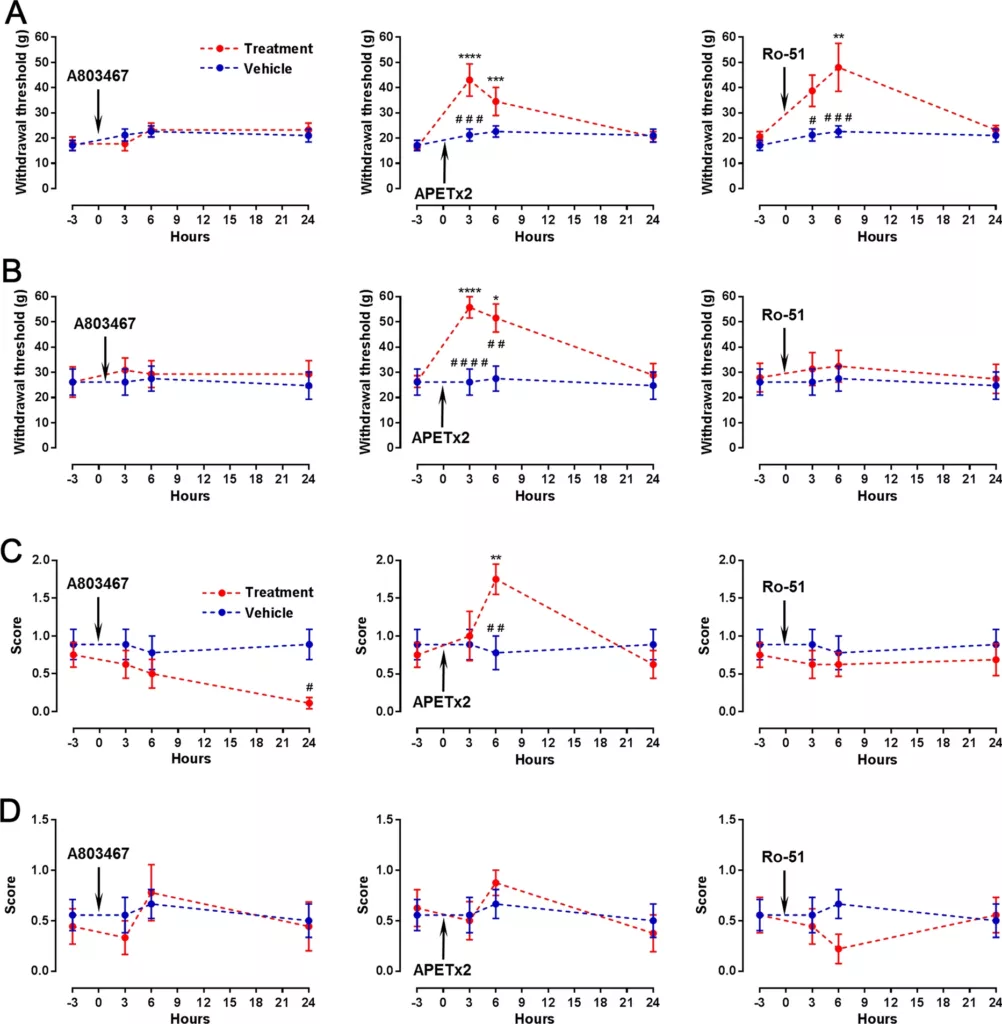
Estamos ahora finalizando un extenso estudio en el que evaluamos de qué manera la regulación de estos receptores nociceptivos puede usarse como herramienta para el tratamiento del dolor crónico inflamatorio en roedores jóvenes vs. envejecidos, lo cual abre la puerta a la introducción y validación de nuevas estrategias para el tratamiento de este dolor en poblaciones geriátricas.